¿Qué es un modelo para la ciencia?
¿Qué observas en las imagenes anteriores?
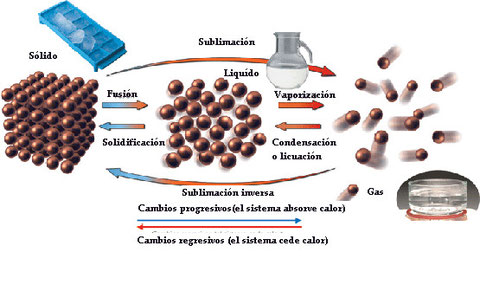
Modelo discontínuo de la materia
Este modelo científico nos permite explicar determinados fenómenos relacionados con la composición, las interacciones y las transformaciones de la materia.
El mismo consiste en señalar que la materia está formada por partículas tan pequeñas que no pueden ser vistas y que entre las mismas existe espacio vacío, es decir, "nada".
Las partículas que forman un mismo tipo de materia son iguales entre sí y aunque dicha materia experimente transformaciones las partículas no se modifican.
Actividad:
Utilizando modelos representa los estados de agregación de la materia. Puedes utilizar papel, espuma plast, cartulina etc.
Estados de agregación de la materia
¿Qué estados de la materia puedes observar y en dónde?
Características macroscópicas de los estado de la materia
|
Sólido |
Líquido | Gaseoso |
| Tiene forma propia | No tiene forma propia, adopta la forma del recipiente que lo contiene | No tiene forma propia |
| No se comprime prácticamente cuando se lo somete a presión | Se comprime algo más que el estado sólido | Fácilmente compresible |
| Tiene volumen propio | Tiene volumen propio | No tiene volumen propio, ocupa todo el volumen disponible del recipiente que lo contiene. |
| Se dilata poco | Tiene mayor dilatación que el estado sólido | Experimenta grandes dilataciones |
Características de los estados de la materia utilizando el Modelo Discontínuo de la Materia
| Estado | Sólido | Líquido | Gaseoso |
| Partículas | Muy juntas | Unidas en grupos desiguales y variables | Muy separadas |
| Espacio vacío | Mínimo o casi nulo | Mayor que en el estado sólido | Muy grande |
| Movimiento | Las partículas sólo pueden vibrar en el lugar | Las partículas pueden vibrar, rotar y trasladarse, cambiando de un grupo a otro | Las partículas tienen gran movimiento |
| Orden | Las partículas están ordenadas en forma tridimensional | El orden consiste en la formación de los "grupos" de partículas | Las partículas están desordenadas |
| Fuerzas de cohesión | Las fuerzas de cohesión entre las partículas son enormes | Existen fuerzas de cohesión, pero son menores que las existentes entre las partículas en el estado sólido | Prácticamente se puede considerar que no hay fuerzas de cohesión entre las partículas |
Interpretación de los cambios de fase utilizando el modelo discontinuo de la materia

Algunas cuestiones:
- ¿Por qué piensas tu que al entregar determinada energía a un sistema en estado sólido este se transforma en líquido?
- ¿Observando la imagen que sucede con la estructura del sólido?
- ¿Qué sucede con el movimiento de las partículas a medida que seguimos entregando energía?
- ¿Qué sucede si el sistema gaseoso cede o pierde energía?
- ¿Qué tiene que ocurrir con las partículas en el estado gaseoso para transformarse en un líquido?
Sistemas materiales
Un sistema es una porción del universo que se aisla para su estudio , posee límites físicos reales o imaginarios y está compuesto por materia.
- Sistemas heterogéneos:
Son sistemas formados por más de una fase.
Las mezclas heterogéneas se pueden clasificar en:
- Macroscópicas: las fases se distinguen a simple vista. Ej: agua y aceite.
- Emulsiones y suspensiones: para distinguir las fases se necesita un microscópio. Ej: leche.
- Coloides: Para distinguir las fases se necesita un ultramicroscópio. Ej: gelatina.
Ejemplos:
Métodos de separación de fases:
Permiten separar las diferentes fases de un sistema heterogéneo.
Tamización: Utilizando un tamiz se pueden separar sólidos cuyas partículas son de diferente tamaño.
Disolución: En un líquido apropiado se puede separar alguna de las fases sólidas de un sistema.
Activdades:
Sigue el hipervínculo haciendo click sobre el texto el que te llevará a videos, observa los mismos los cuales son referidos a mezclas y su separación y responde:
- ¿Qué método o métodos utilizarías para separar un sistema formado por agua - arena y limaduras de hierro?
- ¿Cómo podrías separar los componentes de un sistema formado por agua y aceite?
- Toma como ejemplo los videos y realiza uno propio en donde tengas que realizar la separación de un sistema formado por dos o más fases a tu elección. Ten en cuenta nombrar el o los métdos utilizados y los componentes del sistema.
2. Sistemas homogéneos:
Los sistemas homogéneos son aquellas que constan de una sola fase
Ejemplos:
Actividades:
- Nombra ejemplos de sistemas homogéneos, realiza una lista. Busca información en la web.
- ¿Cómo podríamos obtener los componentes del vino?
- ¿Cómo podríamos obtener los componentes de la tinta?
- ¿Qué son las aleaciones?
- ¿Dónde se utilizan las amalgamas y cómo están compuestas?
Los sistemas homogéneos se pueden clasificar en soluciones y cuerpos puros.
A - Soluciones:
Son las mezclas homogéneos formadas por más de un componente. Las soluciones constan generalmente de un componente que se encuentra en menor proporción denominado soluto y uno que se encuentra en mayor proporción denominado solvente.
Las soluciones pueden ser líquidas (agua de mar), gaseosas (aire) o sólidas (aleaciones).
Podemos obtener los componentes de una solución aplicando algún método de fraccionamiento.
Teniendo en cuenta la realción cantidad soluto - scantidad solvente se puede clasificar a las soluciones en diluídas (cuando la cantidad de soluto es muy pequeña comparada con la de solvente) y concentradas (cuando la cantiidad de soluto es considerable en comparación con la cantidad de solvente).
Existe una propiedad de las mezclas que nos permite establecer la relación soluto - solvente que se denomina Solubilidad.
Métodos de fraccionamiento:
Permiten separar los componentes de un sistema homogénea (soluciones).
Destilación simple. Permite obtener un líquido puro a partir de una solución formada por un sólido y un líquido. En este caso los puntos de ebullición de ambas sustancias presentan una gran diferencia de temperatura. Destilación de alcoholes, obtención del agua destilada.
Destilación fraccionada: La diferencia con la destilación simple es que los puntos de ebullición de las sustancias que forman la solución difieren en pocos grados de temperatura en sus puntos de ebullición. Ejemplo destilación del petróleo.
Cromatografía: Consiste en la separación de los componentes de una mezcla mediante una fase móvil y una fase estacionaria. Fase móvil, gas o líquido, fase estacionaria, sólida o líquida.
Formas de expresar la concentración de una solución:
Existen diferentes formas de expresar la concentración de una solución:
- g/L: gramos por litro.
- %m/m: porcentaje masa - masa.
- %m/v: porcentaje masa - volumen, etc.
Ejercicios:
1. ¿Cómo se prepara una solución de 2 litros de cloruro de sodio en agua (salmuera) con una concentración de 5g/L ? Realiza una lista con los pasos qué creas necesarios para prepararla.
2. Queremos preparar 3 litros de una solución de sal común en agua, cuya
concentración sea de 3 g / l. ¿Cuánta sal común debemos pesar?
3. Si tenemos 30 g de sal común y queremos preparar una solución cuya
concentración sea 15 g/l, ¿cuál será el volumen de la solución?
Solubilidad:
Cantidad máxima de soluto que se disuelve en 100mL de un determinado solvente a una temperatura determinada.
Por medio de esta propiedad podemos determinar si una solución es insaturada (la solución contiene menor cantidad de soluto del que se puede disolver en el solvente), saturada (la solución contiene la máxima cantidad de soluto del que puede disolver el solvente) o sobresarutada (la solución contiene más soluto del que puede disolver el solvente).
Factores que afectan las solubilidad:
La solubilidad se ve afectada por la variación de la presión o la temperatura a la cual se encuentre , por ejemplo la solubilidad en agua de la mayoría de los sólidos, aumenta al incrementar la temperatura o cuando aumentamos la presión la solubilidad de los gases en los líquidos incrementa.
Ejemplos:
1. Si la solubilidad de la sal a 20 ºC es de 36g cada 100mL de solvente (agua) ¿Cuántos gramos de sal podemos disolver en 150 mL de agua?
Respuesta:
Para resolver estes ejercicio podemos utilizar una simple regla de tres, en donde:
36g de sal.............100mL
x g de sal...............150mL
x= 150mL . 36g / 100mL = 54g de sal
R: Podemos disolver 54 g de sal en 150mL de agua
2. ¿Cuántos mL de agua necesitamos para disolver 300 g de azúcar si la solubilidad del azúcar es de 203,9 g/ml a 20ºC?
Respuesta:
203,9g de azúcar .......... 100mL de agua
300g de azúcar ............. x mL de agua
x= 300g . 100mL / 203,9g = 147,1 mL de agua
R: Se necesitan 147,1 mL de agua para disolver 300g de azúcar a 20ºC.
Ejercicios de solubilidad:
1. El cloruro de plata (AgCl) es una sustancia muy poco soluble en agua. Su disolución saturada, ¿será diluida o concentrada?
2. La solubilidad de la tiza en agua es de 0'001 g de tiza por cada 100 g de agua. ¿Qué cantidad de agua se necesitará para disolver 2 g de tiza? ¿Qué cantidad de tiza se disolverá en 1 l de agua? (La densidad del agua es de 1 g/cc).
Actividades:
Construir el gráfico que muestre la variación de la solubilidad de las tres sales en función de la temperatura, a partir de los datos de la tabla de solubilidad.
| Tabla de Solubilidad (gramos de soluto/100mL de agua) | |||||
| 0ºC | 20ºC | 40ºC | 60ºC | 80ºC | |
| Cloruro de potasio | 28 | 34 | 40 | 45 | 51 |
| Sulfato de cobre (II) | 14 | 21 | 29 | 40 | 55 |
| Nitrato de potasio | 13 | 32 | 64 | 110 | 169 |
B - Cuerpos puros:
Los cuerpos puros son sistemas homogéneos que no se pueden fraccionar por ningún método de fraccionamiento.
El concepto de pureza difiere en el término de la química y en el cotidiano. Cuando se habla de puro quiere decir que el aire, el agua, etc, no contienen ningún componente agregado.
Ni el aire ni el agua son cuerpos puros en el sentido que esta palabra tiene en Química, ya que estos sistemas se pueden fraccionar en partes con diferentes propiedades intensivas.
Los cuerpos puros con iguales propiedades intensivas están formados por una sustancia.
Sustancia:
Porción de materia identificable a través de un conjunto de popìedades características como punto de fusión, ebullición, densidad, calor específico, etc.
Tipos de sustancias:
Sustancias compuestas: Son aquellas sustancias que se pueden descomponer en otras. Por ejemplo, el agua se puede descompones en lo elementos químicos que la constituyen oxígeno e hidrógeno a través de una hidrólisis. Ej.: H2O, NaCl, CO2
Sustancias simples: son aquellas sustancias que no se pueden descomponer en otras. Por ejemplo, el hidrógeno y el oxígeno no se pueden descomponer por ningún método.
Ej.: N2, H2,O2
Métodos de descomposición:
Termólisis: descomposiscion por calentamiento.
Electrólisis: descomposición por acción de la corriente eléctrica.
Los métodos de descomposición son denominados procesos químicos porque transforman sustancias en otras más sencillas.
En la materia pueden ocurrir cambios constnatemente, los cuales pueden ser físicos o químicos.
En un cambio o proceso físico no se ve alterada la identidad química de las sustancias participantes del cambio.
En un cambio o proceso químico cambia la identidad química de las sustancias participantes, es decir, que las sustancias producidas al final del cambio, llamadas productos, serán distintas de la o las sustancias de partida, llamadas reactivos.
Ejemplos de cambios físicos y químicos
|
Durante el proceso de fotosíntesis |
Fenómeno |
|
a- la hoja toma CO2 del aire (también llega el H2O tomada del suelo por la raíz) |
Físico |
|
b- el agua se transforma en Hidrógeno y Oxígeno, |
Químico |
|
c- el Oxígeno se desprende de la planta y vuelve a la atmósfera |
Físico |
|
d- el Hidrógeno reacciona con el Dióxido de Carbono para formar Almidón. |
Químico |
|
En un auto |
Fenómeno |
|
a- se inyecta gasolina en un carburador, |
Físico |
|
b- se mezcla con aire, |
Físico |
|
c- la mezcla se convierte en vapor, |
Físico |
|
d- se quema ( y los productos de la combustión ) |
Químico |
|
e- se expanden en el cilindro |
Físico |
Indica qué imagenes corresponden a cambios químicos y cuáles a cambios físicos
Elementos químicos
Como las sustancias están consttuídas por elementos químicos es necesario su estudio.
Los elementos químicos son el vocabulario de la química y se encuentran representados a través de sus símbolos en la tabla periódica.
Los símbolos químicos se utilizan para identificar los elementos químicos en lugar de sus nombres completos.
La mayoría de los símbolos químicos derivan de las letras del elemento, en español, en ingles, alemán, francés, latín o ruso. La primera letra del símbolo se escribe con mayúscula, y la segunda con minúscula.
Algunos ejemplos de nombres en latín:
Ag de argentum (Plata)
Au de aurum (Oro)
Cu de cuprum (Cobre)
Actividades:
1. Investigar el origen del nombre de algunos elementos químicos: yodo (I), polonio (Po), radio (Ra), Tantalio (Ta) y mendelevio (Md).
Realiza una presentación en la herramienta informática que optes para presentar a tus compañeros.
2. El químico alemán Fritz Haber fue conocido como el iniciador de la guerra química.
Investiga sobre este hecho, en qué época histórica se dio el mismo y con qué compuestos trabajó.
 Química 3º
Química 3º























Escribir comentario
cacho (viernes, 19 agosto 2011 18:01)
la página está buenísima
jeen (sábado, 30 junio 2012 14:19)
nii lee enntenndi peroo essa pagina essaa bbuueenna jajaja :D
Julián (lunes, 23 noviembre 2015 15:48)
No entendi pr en fin en algo me ayudo jajaja:-):-O:-)
ui (jueves, 17 diciembre 2015 14:20)
kkii
m,ll (jueves, 17 diciembre 2015 14:21)
que es la materia
o (jueves, 17 diciembre 2015 14:48)
nada sale de lo que dice
Administrador (sábado, 16 abril 2016 06:43)
La materia es el componente principal de los cuerpos, susceptible de toda clase de formas y de sufrir cambios, que se caracteriza por un conjunto de propiedades físicas o químicas, perceptibles a través de los sentidos.
Tatiana (viernes, 31 marzo 2017 20:41)
excelente!! muy claras las explicaciones. Gracias
Joshua Anubis Martínez Delgado (lunes, 12 octubre 2020 16:05)
Exelente las explicaciones estan muy claras
Joshua Anubis Martínez Delgado (lunes, 12 octubre 2020 16:06)
Exelente
Joshua Anubis Martínez Delgado (lunes, 12 octubre 2020 16:07)
Exelente
Cira pinto leon (viernes, 04 diciembre 2020 08:36)
La informacion aparece bien explicada.
Yoel Ramos Mondragón (sábado, 18 septiembre 2021 09:42)
659
mm.m} (sábado, 11 junio 2022 10:43)
n mnmnmmmnm
Jerelin (viernes, 10 marzo 2023 19:28)
Mmmm